Aveti aici prima lectie pentru bacalaureat.Nu uitati aceasta este o prima editie si se pot mai adaugi.Material gratuit.Nu este de vanzare.O zi faina sa avetu
Reducere Libris.ro
Alchene.Partea I.
SITE IN CONSTRUCTIE
// REVENIM //
CHIMIZAREA METANULUI
CHIMIZAREA METANULUI PRIN OXIDARE
- Prin arderea metanului in aer ,in atmosfera saraca in oxigen se formeaza negru de fum si apa CH4+O2 -> C + 2H2O
- Prin arderea incompleta a metanului se obtine gazul de sinteza CH4 + 1/2 O2 -> CO + 2 H2
- Prin trecerea metanului cu vapori de apa peste un catalizator de Ni la cca. 800 de grade celsius rezulta gazul de apa. CH4 + H2O -> CO + 3H2
- Prin incalzirea metanului la 400 de grade celsius si o presiune de 60 atm. se obtine metanol. CH4 + 1/2 O2 -> CH3OH
- Prin incalzirea metanului la 400-600 de grade celsius in prezenta de oxizi de azot se obtine metanal. CH4 + O2 -> CH2O + H2O
- Prin incalzirea metanului impreuna cu amoniac la 1000 de grade celsius in prezenta platinei se formeaza acidul cianhidric.Aceasta reactie se mai numeste si reactia de amonoxidare a metanului. CH4 + NH3 + 3/2 O2 -> HCN + 3H2O
Alcani.Partea 2.
PROPRIETATI FIZICE SI PROPRIETATI CHIMICE
PROPRIETATI FIZICE
STARE DE AGREGARE
In conditii standard metanul,etanul,propanul,butanul si neopentanul sunt gaze.Alcanii C5-C17 sunt lichizi iar cei si mai superiori sunt solizi.
PUNCTE DE FIERBERE SI TOPIRE
Punctele de fierbere si topire cresc odata cu cresterea numarului de atomi de carbon din molecula.
Izoalcanii au puncte de fierbere mai scazute decat n-alcanii cu acelasi numar de atomi de carbon din molecula
SOLUBILITATE.DENSITATE.
Alcanii nu se dizolva in apa ci in solventi nepolari ca bezina sau tetraclorura de carbon.
Alcanii plutesc deasupra apei (cei solizi) sau stau la suprafata apei (cei lichizi) deoarece au o densitate mai mica decat cea a apei.
MIROS
Alcanii inferiori nu au miros iar cei superiori au un miros caracteristic.Mirosul actual al gazului pe care il folosim la aragaz se datoreaza unor compusi organici ce contin sulf si se numesc mercaptani.Mercaptanii au un miros urat iar cantitatea de mercaptan care trebuie cotinut de o anume cantitate de gaz este foarte mica el putand fi depistati foarte usor in aer in urma unor fisuri etc.
PROPRIETATI CHIMICE
Deoarece alcanii sunt nereactivi la temperaturi joase au fost numiti parafine.
REACTIA DE SUBSTITUTIE
Este reactia caracteristica substantelor organice care contin in molecula legaturi simple sigma
REACTIA DE HALOGENARE
Reactia unui halogen cu un alcan in prezenta luminii ultraviolete sau caldura lasa loc formarii de halogenoalcani. Un exemplu este clorurarea metanului

Triclorometanul mai este cunoscut si sub denumirea de CLOROFORM
Florurarea si iodurarea alcanilor au loc prin procese indirecte.
REACTIA DE IZOMERIZARE
Este reactia prin care n-alcanii devin izoalcani ( i-alcani )
Aceste reactii au loc in prezenta de clorura de aluminiu sau bromura de aluminiu la o temperatura de 50-100 grade celsius sau silicati de aluminiu si temperaturi de 250-300 de grade celsius.

REACTIA DE DESCOMPUNERE TERMICA
Aceasta reactie se desfasoara la temperaturi foarte ridicate.
Daca temperatura este pana in 650 de grade atunci se numeste CRACARE si astfel are loc ruperea legaturilor C-C
Daca temperatura depaseste 650 de grade atunci reactia se numeste reactie de PIROLIZA.
Pe langa aceste reactii au loc si reactii de dehidrogenare

PIROLIZA METANULUI
La o temperatura mai mare de 1200 de grade celsius metanul se supune reactiei de piroliza.Metanul se transforma in acetilena si hidrogen iar ca produs secundar se mai obtine carbon sub forma de praf fin si hidrogen.
2 CH₄ → C₂H₂ + 3 H₂ (reactie principala)
CH₄ → C + 2 H₂ (reactie secundara)
REACTIA DE OXIDARE
REACTIA DE OXIDARE COMPLETA (ARDEREA)
Prin ardere orice alcan se transforma in dioxid de carbon si apa
Ecuatia generala este urmatoarea
CnH2n+2 + (3n+1)/2 O2 -> nCO2 + (n+1) H2O + Q
Unde Q reprezinta caldura degajata din reactie.
REACTIA DE OXIDARE INCOMPLETA
Reactiile de oxidare sunt reactii care:
- cresc continutul de oxigen din molecula
- cresc numarul de legaturi chimice prin care oxigenul se leaga de carbon
- scad continutul de hidrogen in molecula
Alcanii sunt stabili la actiunea agentilor oxidanti insa alcanii superior se pot oxida la acizi carboxilici cu numar mare de atomi de carbon numiti si acizi grasi
R- (CH2)n – CH3 -> R – (CH2)n – COOH
ALCANI.Partea 1.
DEFINITIE,SERIE OMOLOAGA,IZOMERIE,DENUMIRE,STRUCTURA.
DEFINITIE.
Alcanii sunt hidrocarburi saturate aciclice.Au formula generala CnH2n+2.Nesaturarea echivalenta este egala cu 0.
SERIE OMOLOAGA.
Seria omoloaga se obtine dand lui n valori intregi si succesive (n=1,2,3…x).
Fiecare substanta din seria omoloaga a alcanilor difera de cea de dinainte sau cea de dupa printr-o grupare -CH2– ,numita ratie de omolog.
IZOMERIE.
Izomerii sunt compusi care au aceeasi formula moleculara insa difera prin structura lor (care automat le schimba proprietatile).

Alcanii ce prezinta catene liniare se numesc normal alcani (n-alcani) iar cei ce au catena ramificata se numesc izoalcani (i-alcani).
DENUMIREA IZOALCANILOR.
Daca indepartam un atom de H sau mai multi dintr-o hidrocarbura obtinem niste radicali numiti radicali hidrocarbonati.
- Daca indepartam doar un singur atom de hidrogen atunci sufixul -an este inlocuit de sufixul -il
De exemplu
De la metAN CH4 prin indepartarea unui hidrogen obtinem CH3- sau metIL
metAN -> metIL
- Daca indepartam doi atomi de hidrogen atunci sufixul -an este inlocuit cu sufixul -iliden sau -ilen
De exemplu
De la metAN CH4 prin indepartarea a doi atomi de hidrogen obtinem -CH2- metILIDEN sau metILEN
- Daca indepartam trei atomi de hidrogen sufixul -an se inlocuieste cu sufixul -ILIDIN sau -IN
De exemplu
De la metAN CH4 prin indepartarea a 3 atomi de hidrogen obtinem -CH- metILIDIN sau metIN.
DENUMIREA ALCANILOR CU CATENA RAMIFICATA
Pentru a denumi alcanii ce prezinta catena ramificata trebuie sa respectam 3 reguli simple care odata retinute ne vor ajuta si pe viitor in denumirea altor compusi mai grei si cu functiuni complexe.
- Stabilim care este cea mai lunga catena de atomi de carbon (catena de baza). Daca ti se par ca sunt doua devii mai atent si numeri din nou, daca si acum tot doua sunt atunci trecem la o subregula ( 1.a) Daca exista doua catene care au un numar egal de atomi de carbon consideri catena de baza cea care are cele mai multe ramificatii. )
- Numerotezi atent atomii de carbon din catena pe care ai ales-o ca fiind catena de baza iar fiecare cifra reprezinta indicii de pozitii ale ramificatiilor . Numerotarea o faci de la un cap la altul iar corecta va fi numerotarea in care suma indicilor de pozitie a ramificatiilor este minima.
- La numele alcanului corespunzator catenei de baza adaugi si denumirile ramificatiilor in ordine alfabetica fiind necesar sa indici:pozitia la care ii gasesti pe catena de baza in cifre arabe si prin prefixe : di tri penta etc. pentru a arata de cate ori ii gasesti pe aceeasi catena
REZOLVAREA MODELELOR PROPUSE PENTRU BACALAUREAT 2019 – PROBA E.d) CHIMIE ORGANICA
E_d_chimie_organica_2019_var_model_LRO
Acesta este modelul nr. 1 propus de catre minister
REZOLVARE:
SUBIECTUL I
Subiectul A.
1.F
Halogenii nu se aditioneaza conform regulii lui Markovnikov ci doar hidracizii.
Regula lui Markovnikov spune :
La aditia hidracizilor la alchene/alchine nesimetrice ,atomul de halogen se fixeaza la atomul de carbon legat de dubla respectiv tripla legatura care este cel mai sarac in atomi de hidrogen.
2.A
Stearatul de sodiu este sarea acidului stearic,acidul stearic fiind un acid gras.
3.F
La hidroliza partiala a proteinelor se obtin amestecuri de peptide.Peptidele reprezinta 2-10 molecule de aminoacid condensate.
4.F
Zaharoza este o dizaharida deoarece este formata dintr-o molecula de glucoza si o molecula de zaharoza.
5. F
Daca avem un amestec echimolecular de enantiomeri al unui compus organic , prin asta intelegand un volum de enantiomer care intoarce planul luminii polarizate la stanga egal cu volumul de enantiomer care intoarce planul luminii polarizate la dreapta.
Subiectul B.
1.c
2.d
3.b
4.a
Este o reactie de eliminare deoare din molecula respectiv eliminam un atom de hidrogen si un atom halogen.
5.c
Triglicerida este formata din glicerina si 3 moli de acid gras, in cazul nostru singurul acid gras este acidul oleic.
Subiectul C.
1.f
2.a
3.d
4.e
5.c
SUBIECTUL al II-lea
Subiectul D.
1.
a. Grupa functionala monovalenta hidroxid.
b.

Acesta este compusul nostru scris intr-o noua forma de zig-zag.
Ni se cere raportul de carbon primar la carbon secundar.
Carbonii 1,4,5 sunt primari
Carbonul 2 este secundar.Multi din graba faceti greseala si l-ati considera tertiar INSA el se leaga doar de 2 alti atomi de carbon ceea ce il face secundar.
Carbonul 3 este tertiar (nu il luam in considerare in calculul nostru)
In final raportul este de 3:1
2.

O legatura este formata din 2 electroni.
Legaturile notate cu S sunt legaturile sigma care se stabilesc in compusul nostru.
In acest compus care are formula C5H12O sunt 17 legaturi sigma adica 34 de electroni implicati in aceste legaturi.
Electronii neparticipanti sunt acei electroni care au ramas necuplati in vederea stabilirii starii stabile de octet al unui element si acest lucru il vedem la oxigen care are 2 legaturi adica 4 electroni din 8 sunt implicati in legaturi iar ceilalti pana la 8 adica 4 sunt electroni neparticipanti.
Deci raportul este 34:4 ,simplificand avem 17:2
3.
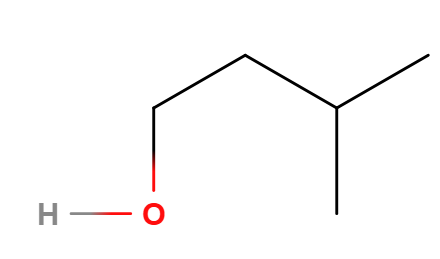
Tot ce am facut a fost sa mut gruparea -OH.
4.
a.
Formula moleculara este C5H12O
b.
In formula moleculara avem 5 atomi de carbon adica 60 de grame de carbon , 12 atomi de hidrogen adica 12 grame si 1 atom de oxigen adica 16 grame de oxigen
Raport masic de combinare C:H:O=60:12:16 simplificand avem 15:3:4
5.
Etanolul are formula moleculara C2H6O
Masa molara este 46 g / mol
La 46 g de etanol avem 16 grame oxigen
La 13,8 g etanol avem x grame oxigen
Prin regula de 3 simpla deducem ca
x=(13.8*16)/46=4.8 grame oxigen din etanol
Masa molara a compusului A este 88 g/mol
Daca 88 g compus A contine 16 g oxigen
Cat x g compus A contin 4.8 g oxigen
x=26.4 g compus A contin atatea grame de oxigen cat contin si 13.8 g de etanol.
Subiectul E.
1.
a.
C3H6+H2 –(Ni)–> C3H8
b.
2.
CaC2 + 2H2O –> C2H2 + Ca(OH)2
3.
Aflam numarul de moli de acetilena
112/22,4=5 moli acetilena
Aflam numarul de moli de carbid
400/64=6,25 moli carbid
Dintr-un mol de carbid ne rezulta un mol de acetilena deci teoretic din 6,25 moli carbid trebuie sa obtinem tot 6,25 moli acetilena dar practic obtinem 5 moli de acetilena.
Din formula randamentului
n=cp/ct*100 ne rezulta un randament de obtinere a acetilenei egal cu 80%
4.

5.
Aflam numarul de moli de benzen care este de 5 kmoli
Aflam numarul de moli de nitrobenzen care este de 3,5 kmoli
Reactia are loc mol la mol deci din 5 kmoli de benzen ar trebui sa obtinem teoretic 5 kmoli de nitrobenzen dar practic obtinem 3,5 kmoli astfel ca randamentul nostru de nitrare conform formulei este de 70%
SUBIECTUL al III-lea
Subiectul F
1.
a.

b.
Stim densitatea si volumul asa ca vom afla cantitatea (kg) de solutie alcoolica care este egala cu 0,9*230 =207 kg solutie alcoolica
Din aceasta solutie 20% este etanolul care intra in reactie si cantareste 41,4 kg adica in moli avem 0,9 kmoli etanol.
Reactia este mol la mol deci din 0,9 kmoli etanol obtinem tot 0,9 kmoli dar de acid acetic.
Cum ni se cere masa de acid acetic ,vom inmulti masa molara a acidului acetic cu numarul de moli de acid acetic obtinuti si rezulta o masa de 54 kg acid acetic
2.

3.
Concentratia molara ne indica numarul de moli dizolvati intr-un litru de solutie.
Avem 0,05 moli de acid care va fi neutralizat de tot atatia moli de hidroxid.Deci,rezulta ca volumul solutiei de hidroxid de potasiu este egal cu 500 mL.
4.

5.
a.

b.
Grasimile se dizolva in alcooli si hidrocarburi. Un solvent ar putea fi toluenul.
Subiectul G.
1.
Lectia 2. Hidrocarburi.Introducere.
Inainte sa incepem studiul efectiv al claselor de hidrocarburi doresc sa va fac o mica introducere in aceasta „lume” daca pot sa ii zic asa.
Din denumirea aceasta „hidrocarburi” ne putem da seama fara prea mult efort originea acestora si din ce sunt compusi acesti compusi organici.Partea din fata „hidro-” vine evident de la HIDROGEN iar ultima parte a cuvantului „-carburi” vine la fel de evident ca si in cazul hidrogenului de la CARBON.Deci spunem ca hidrocarburile sunt compusi organici care contin in molecula lor doar atomi de carbon si hidrogen.
Deci putem spune ca o formula generala a hidrocarburilor ar putea fi de forma CxHy unde x ne indica numarul de atomi de carbon din molecula iar y ne indica numarul atomilor de hidrogen din molecula noastra.
Clasificarea HIDROCARBURILOR
Hidrocarburile se pot clasifica in doua moduri.Odata se pot clasifica in functie de modul in care se dispun atomii de carbon in catena si in acest caz avem:
- HIDROCARBURI CU CATENA ACICLICA – aceste hidrocarburi contin in molecula lor ori o structura liniara ori o structura ramificata (aciclica)
- HIDROCARBURI CU CATENA CICLICA – aceste hidrocarburi contin unul sau mai multe cicluri de atomi de carbon
Iar daca vom clasifica hidrocarburile dupa natura legaturilor chimice avem
- HIDROCARBURI SATURATE – ALCANI – au in molecula lor DOAR legaturi simple
- HIDROCARBURI NESATURATE – ALCHENE , ALCADIENE , ALCHINE – au in molecula lor macar o legatura dubla sau tripla intre doi atomi de carbon.
- HIDROCARBURI AROMATICE – ARENE – contin in molecula lor CEL PUTIN un CICLU BENZENIC
Asta a fost lectia pentru azi!Ca de fiecare data va recomand sa invatati cu foarte mare atentie din manual si nu uitati sa repetati si din urma!
REZOLVAREA PROBLEMELOR LECTIA 1
Pentru a primi rezolvarea problemelor in format PDF va rugam sa ne lasati in comentarii mail-ul vostru.Zi cat mai faina si la cat mai multe probleme!!!
PROBLEME REZOLVATE LECTIA 1 INTRODUCERE IN STUDIUL CHIMIEI ORGANICE
- Se ard 3,6 g hidrocarbura si se obtin 11 g CO2 si 5,4 g H2O.
Aflati formula moleculara,procentuala si scrieti structurile posibile.Î - Se ard 5,6 g de CO2 si 7,2 g H2O.
Aflati formula moleculara bruta,procentuala si scrieti structurile posibile. - În urma combustiei a 3.52 g substanţă organică s-au obţinut 7.04 g CO2 şi 2.88 g H2O.Determină formulele procentuală, brută şi moleculară, ştiind că substanţa organică are masa molară 88 g /mol.
- S-a supus analizei elementare o hidrocarbură cu masa molară 84 g /mol. S-au analizat 1,68 g hidrocarbură şi s-au obţinut 120 mmoli CO2. Determină formula moleculară a hidrocarburii şi scrie o formulă de structură posibilă ştiind că are în moleculă o legătură π.
- În molecula unei substanţe organice care conţine 2 atomi de brom, numărul atomilor de hidrogen este de două ori mai mare decât numărul atomilor de carbon. În urma analizei a 2,16 g din aceeaşi substanţă organică s-au obţinut 3,76 g precipitat , alb-gălbui de AgBr. Determină formula moleculară a substanţei organice şi calculează-i compoziţia procentuală.
- O substanţă organică necunoscută formează la descompunerea termică (sau analiza) a 1,86 g substanţă, 448 ml CO (c.n.), 1,76 g CO2 şi 1,62 g H2O. Ştiind că molecula substanţei organice conţine 2 atomi de carbon, determină formula ei moleculară.
- Densitatea în raport cu aerul a unei hidrocarburi care conţine 20 % H este de 1,038. Care este formula moleculară a hidrocarburii.
- S-au supus analizei elementare 0,2 moli dintr-o substanţă organică, A şi s-au obţinut
2,24 l N2. Dioxidul de carbon obţinut a fost barbotat în 400 ml soluţie de Ca(OH)2 de
concentraţie 0,1 M obţinându-se 60 g de precipitat de CaCO3. Apa obţinută,introdusă în 200 gsoluţie de H2SO4 de concentraţie 30 % îi scade concentraţia la 28,22 %. Ştiind că în molecula substanţei A se găsesc, pe lângă alţi atomi şi 2 atomi de O determină formula moleculară asubstanţei A. - În condiţii normale 532 cm3dintr-o hidrocarbură gazoasă cântăresc 1,33 g şi formează,prin arderea a 2,1 g hidrocarbură, 6,6 g CO2. Determină formula moleculară a hidrocarburii.
- Determină formulele brute ale substanţelor care au rapoartele de masă:
a) C : H : O = 3 : 1 : 4;
b) C : H : N = 6 : 2 : 7;
c) C : H : N : O = 9 : 2 : 7: 8 - În urma analizei a 6,32 g substanţă organică a cărei moleculă este formată din carbon,hidrogen, oxigen şi un atom de sulf s-au obţinut 5,376 l CO2, 2,16 g H2O şi 9,56 g PbS.Determină formula moleculară a substanţei.
Pozele cu rezolvarile si explicatiile aferente vor fi postate de maine si in cursul saptamanii viitoare.Daca exista si alte probleme care va dau batai de cap la acest capitol astept cu placere sa imi dati textul acestora in comentarii.
